近日,必赢线路检测中心iHuman研究所、生命科学与技术学院水雯箐课题组联合徐菲课题组,在国际学术期刊《美国化学会志》(Journal of the American Chemical Society)发表了题为“Structural Mass Spectrometry Captures Residue-Resolved Comprehensive Conformational Rearrangements of a G Protein-Coupled Receptor”的研究论文,发展了基于限制性蛋白酶切的质谱(LiP-MS)技术,在氨基酸位点分辨水平上全面描绘G蛋白偶联受体(GPCR)在多种条件下的构象转变与灵活性,为GPCR结合不同配体和G蛋白偶联状态下的结构动态性研究提供了新视角与新方法。

通过X射线晶体学或单颗粒冷冻电镜技术解析的GPCR复合物三维结构,虽然极大加深了我们对GPCR激活机制的理解,但这些结构快照难以完整揭示GPCR在溶液相或者细胞生理环境中的动态构象变化。近年来,基于光谱的方法被应用于探测GPCR蛋白的构象动态性,但这些方法通常需要对某个位点进行标记,无法获得全局性的构象变化信息。
本研究建立了一种基于LiP-MS的结构质谱技术(图1),能够同时监测GPCR在多个结构域上位点分辨的构象转变,包括柔性的环状区以及跨膜螺旋区。通过监测PK酶对各个位点的酶切可及性,本工作探究了腺苷2A受体(A2AR)在多种配体(2种激动剂、1种拮抗剂和3种别构调节剂)结合下以及与G蛋白偶联过程中的构象动态变化。
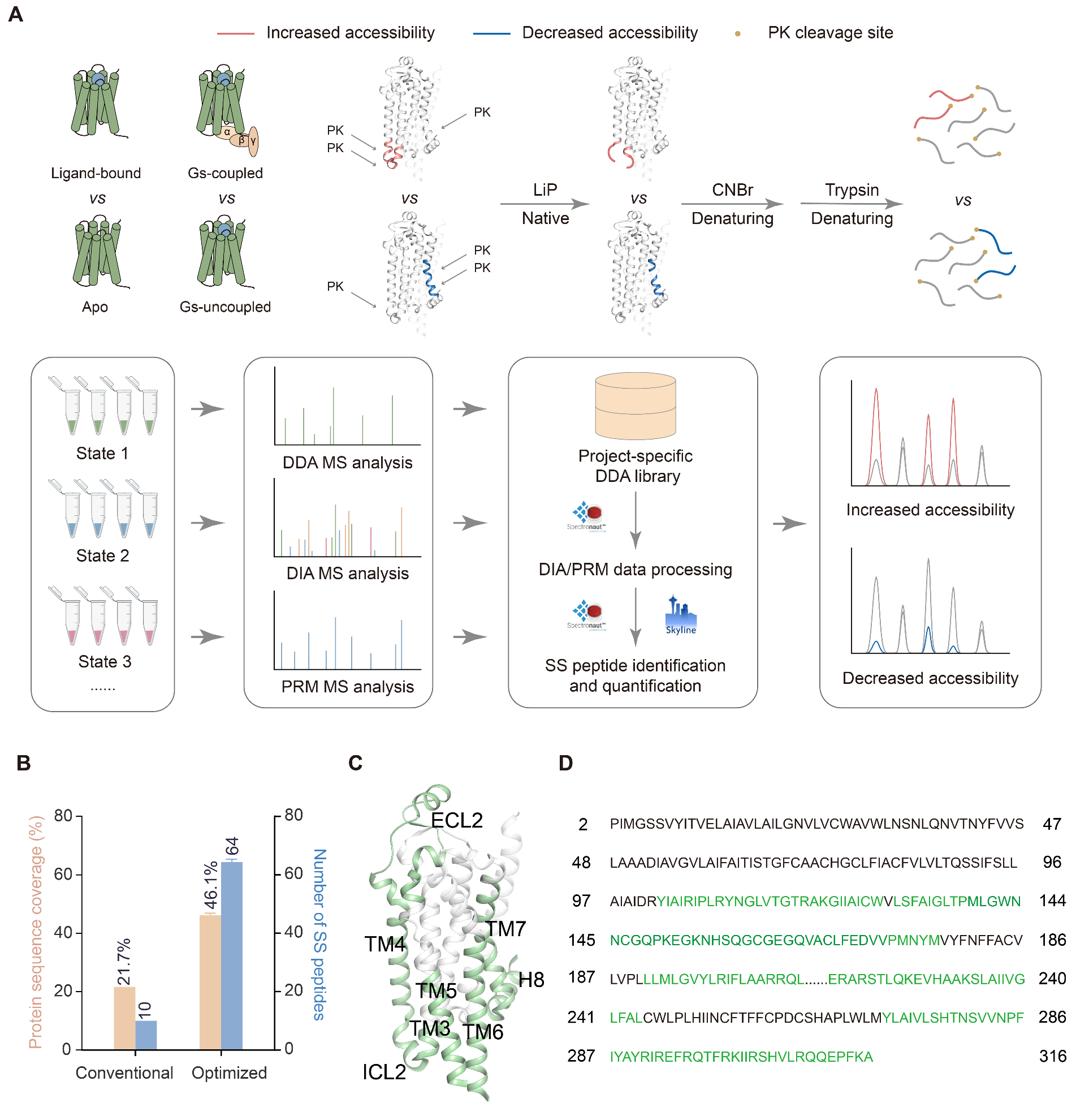
图1. LiP-MS技术的流程示意图
通过与已解析的晶体结构对比,研究人员发现LiP-MS结果能精确反映配体结合和受体激活在多个结构域中的结构机制。例如,在正构配体作用下,受体第二个胞外环(ECL2)区域中多个位点、尤其是配体直接结合位点,均显示出PK可及性降低,这表明该区域由于配体结合作用使其刚性增加。类似的区域还包括受体激活过程中关键的基序(如NPXXY)、G蛋白与受体互作界面中的第二个胞内环(ICL2)等。
基于LiP-MS的结构质谱分析也反映出已解析结构并未披露的局部构象动态性。如在G蛋白偶联过程中,除了监测到ICL2前半段(对应G蛋白结合界面)和第六个跨膜螺旋(TM6)(对应受体激活核心区域)等的构象转变,还发现受体ICL2后半段的动态性升高,而这点无法直接用已解析的晶体结构阐释(图2)。此外,本工作还研究了多种不同类别的配体对受体的构象扰动作用。以上研究证实,基于LiP-MS的受体结构指纹图谱可以准确分类不同药理学性质的配体,并区分G蛋白偶联和非偶联状态。
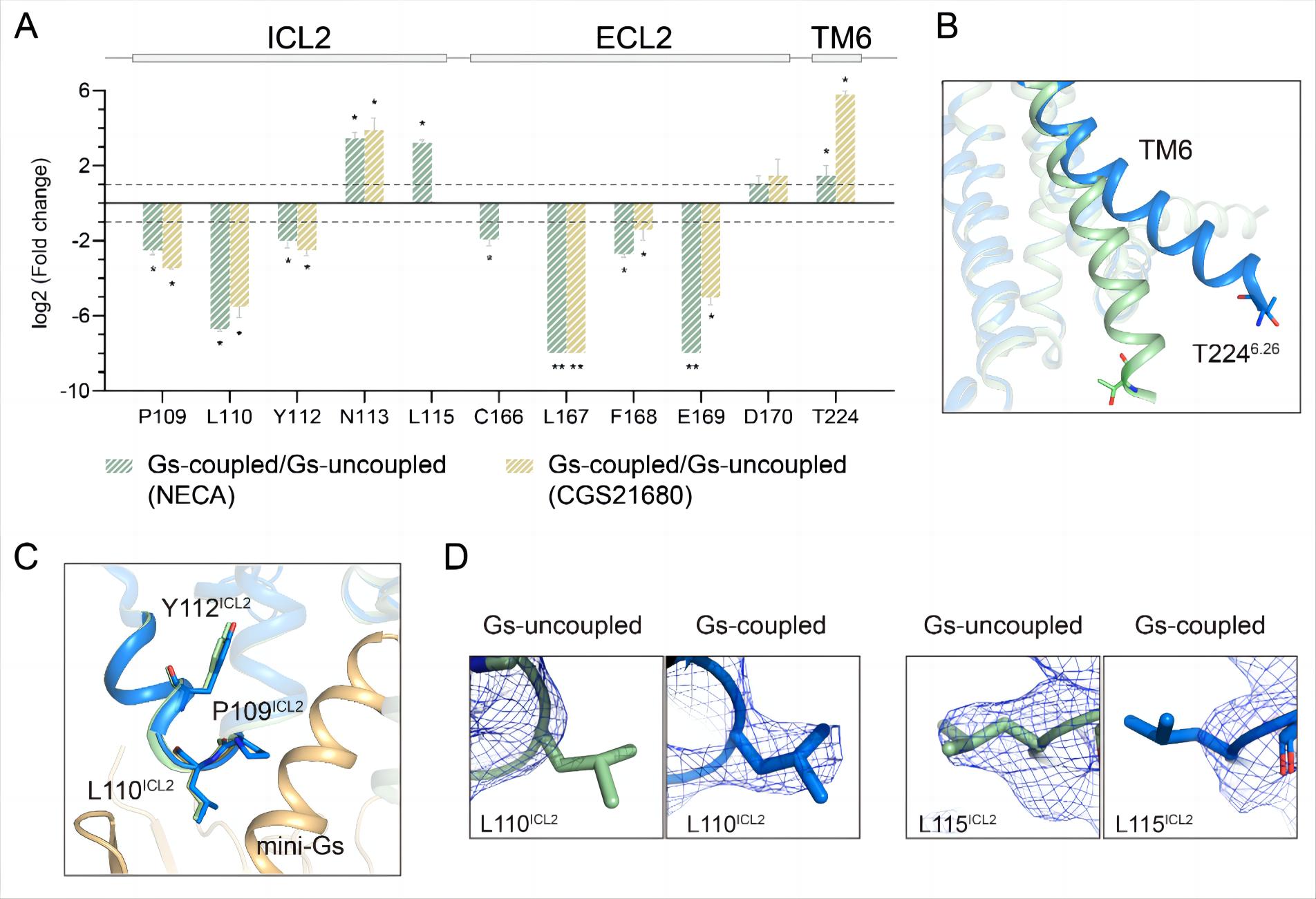
图2. LiP-MS捕捉G蛋白偶联过程中的受体构象重排
综上所述,本工作建立了一种新型结构质谱方法,用于在溶液中对GPCR的构象变化实现位点分辨、覆盖多个结构域的全面解析。LiP-MS以其高灵敏度、高特异性和高通量,与当前GPCR结构和动态研究技术高度互补,能够帮助我们深入理解GPCR复杂药理学的结构基础,并为基于结构的药物发现提供新视角与新技术。
必赢线路检测中心生命科学与技术学院2021级博士研究生刘红月与2021级硕士研究生严鹏飞为论文的共同第一作者。iHuman研究所研究员、生命学院常任副教授水雯箐与iHuman研究所研究员、生命学院常任教授徐菲为该工作的共同通讯作者。中国科学院上海药物研究所的郑杰研究员、复旦大学基础医学院周庆同研究员与上海交通大学医学院张健教授作为合作者,为本研究提供了大力支持。必赢线路检测中心为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号